最終更新日 2023年10月1日
美容皮膚科で扱われているボトックス注射にはいろいろ種類があります。
- どれを選べばいい?
- どのボトックス注射がお勧め?
- 違いはあるの?
今回の記事では、そんな疑問にお答えします。
ボツリヌストキシン製剤
ボトックスの種類は実は1つ
「ボトックスの種類」について患者さんから訪ねられることがあります。ボトックス(BOTOX®)は米国アラガン社の製品名ですので、実はボトックスの種類は1つしかありません。
「でもいくつも種類があるよ。韓国製とかもあるし。」そう思われる方も沢山いらっしゃると思いますが、そんな疑問についても解説していきます。
国内で「ボトックス」と名前が付く製品は以下の2つです。
- ボトックスビスタ®
-
自費診療用。「眉間と目尻の皺」に承認された製剤。
- ボトックス®
-
保険診療用。「重度の腋窩多汗症」などに承認された製剤。
ボトックスビスタはアラガン・ジャパン社が製造販売、ボトックスはグラクソ・スミスクライン社が販売していますが、アラガン社から製造販売承認を承継しています。
つまり、ボトックスビスタとボトックスは、同じ製造方法で作られていて、全く同一の医薬品です。
ボトックスはボツリヌス毒素(ボツリヌストキシン)製剤の先発品で最も有名であり、代名詞となっています。そのため、他のボツリヌス毒素製剤もボトックスと呼ばれることがあります。
しかし、「ボトックス®」は商標登録されているので1種類だけ(ボトックスとボトックスビスタですが、両者は同一)で、他の製剤は、ボトックスという名称を使用してはいけないことになっています。
それでは、他のボツリヌストキシン製剤にはどんな種類があるのでしょうか?
ボツリヌストキシン製剤の種類
ボツリヌス毒素(ボツリヌストキシン)は、毒素型によってA・B・C・D・E・F・Gの7種にわけられています3。
医療で人に使用されるボツリヌストキシンはA型とB型の2つです。B型ボツリヌストキシン製剤は痙性斜頸等に使用されるナーブロック(米国:MYOBLOC)のみで、美容領域ではすべてA型が利用されています。
ボトックスの他にも沢山の製品があり、世界各国で製造されています。
| 製品名 | 製造販売 | 人血清アルブミン 動物由来原料 | 複合タンパク | 特徴 |
|---|---|---|---|---|
| ボトックスビスタ BOTOX Vista | アラガンジャパン | 使用 | あり | 国内承認 |
| ボトックス BOTOX | グラクソスミスクライン | 使用 | あり | ビスタ同一品 国内承認 保険診療用 |
| コアトックス CORETOX | 韓国/メディトックス | 不使用 | 除去 | 韓国MFDS承認 |
| ボコーチュア (ゼオミン) BOCOUTURE | ドイツ/メルツ | 使用 | 除去 | 25℃以下保存 米FDA承認 韓国MFDS承認 |
| ゼオマイン XEOMIN | 帝人ファーマ | 使用 | 除去 | ボコーチュア同一品 国内承認 保健診療用 |
| イノトックス INNOTOX | 韓国/メディトックス | 不使用 | あり | 液体型 韓国MFDS承認 |
| ニューロノックス Neuronox | 韓国/メディトックス | 使用 | あり | 韓国MFDS承認 |
| ディスポート Dysport | フランス/イプセン | 使用 | あり | 米FDA承認 |
| ボツラックス Botulax | 韓国/ヒューゲル | 使用 | あり | 韓国MFDS承認 韓国向け製品 |
| リジェノックス REGENOX | 韓国/ヒューゲル | 使用 | あり | ボツラックス同一品 韓国MFDS承認 海外向け製品 |
| ヒュートックス HUTOX | 韓国/ヒューオン | 使用 | あり | 韓国MFDS承認 |
| マイオブロック MYOBLOC | 米/スパーナス | 使用 | あり | B型ボツリヌストキシン 米FDA承認 |
| ナーブロック NerBloc | エーザイ | 使用 | あり | マイオブロック同一品 B型ボツリヌストキシン 国内承認 保険診療用 |
同一成分の製品
「ボトックスビスタ」と「ボトックス」に代表されるように、同一成分を使用した別名の製品もあります。
これは、ライセンスの継承を他の製薬会社に行う際に名称変更したり、国内向けと海外向け製品の名称変更をしたりするためです。
- ボトックス・ボトックスビスタ
- ゼオミン・ボコーチュア・ゼオマイン
- ボツラックス・リジェノックス
- ナーブロック・マイオブロック
ドイツのメルツ社の「ゼオミン(XEOMIN)」は、眼瞼痙攣等に用いられていましたが、2010年にシワ治療用途のブランド「BOCOUTURE(ボコーチュア・ボカチャー・ボクチャー)」に名称変更されました。
帝人ファーマ株式会社の「ゼオマイン」はメルツ社から独占販売権を獲得したもので、ボコーチュア、ゼオミンと同一製品です。
その他、ボツラックスとリジェノックス、マイオブロックとナーブロックも同一製品です。

バイオシミラー(バイオ後続品)
バイオシミラー(バイオ後続品)とは、先発医薬品(つまりBOTOX®)と品質、安全性、有効性において同等性を持った医薬品です。
- ニューロノックス
- ボツラックス
- リジェノックス
- ヒュートックス
バイオシミラーは、ボトックスに対する非劣性試験をクリアして、韓国MFDS承認を受けており、その効果は同等と考えて良いでしょう。

韓国Hugel社製のボツリヌストキシン製剤。韓国国内では「Botulax® ボツラックス」の製品名、海外向けには「Regenox® リジェノックス」の製品名で販売しています。
リジェノックスは製造元は韓国Hugel社で、販売元は韓国Hans Biomed社。
どの製剤がおすすめ?
各ボツリヌストキシン製剤の違いや特徴を比較していきます。
国内承認薬のほうが安全?
「ボトックスビスタは日本で承認されているから一番安全性が高く、韓国製ボトックスは品質が悪く危険。」
そんな情報も目にしますが、果たして本当でしょうか?
医薬品副作用救済制度
国内承認薬は、万が一重篤な副作用が起こった際に「医薬品副作用救済制度」といった救済制度があります。これがあると安心だと考える患者さんもいますが、実はそう単純でもありません。
ボトックスビスタⓇが使えるのは眉間と目尻のしわだけ
国内承認薬の「ボトックスビスタ®」が治療承認を得ているシワの種類は、「眉間のシワ」と「目尻のシワ」だけ。その他の用途に使用した場合は「未承認の適応外使用」です。
つまり、「おでこのシワ」や「エラの張り」にボトックスビスタを使用した場合、未承認の適応外使用となり救済制度は適用されません。
実際にボトックスビスタの添付文書には、赤字で以下の記載があります。
眉間の表情皺及び目尻の表情皺以外には使用しないこと
ボトックスビスタ添付文書4
実際には、多くの美容クリニックでボトックスビスタで眉間と目尻以外のシワ治療をしているにもかかわらず、「承認されているので安心です。」と宣伝されています。
本当は、ボトックスビスタが用途によって「未承認」で「医薬品副作用救済制度の対象外」であることを患者さんへ説明してから治療しなければなりません。
ボトックス®が使えるのは重度の脇汗
「ボトックス®」はボトックスビスタと同一成分ですが、シワ治療目的として承認されていない製剤です。
「重度のワキ汗」「痙性斜頸」「眼瞼痙攣」に対して承認されています。
痙性斜頸などで国内承認を受けているB型ボツリヌストキシン製剤の「ナーブロック®」も、シワは適応外です。
ボツリヌストキシン製剤は、シワや多汗症だけでなく、眼瞼痙攣、肩こり、花粉症など、幅広い疾患に役立っている一方で、日本で承認が取れているのは、その中のごく一部の疾患だけです。
治療したい部位に対して未承認薬しかない場合、ボトックスビスタやボトックスに拘る理由はほとんどありません。
ちなみに、私は皮膚科・美容皮膚科・内科・循環器科を合わせて20年以上医師として働いていますが、医薬品副作用救済制度が適用された方は一人もいません。
品質管理の問題
ボツリヌストキシン製剤は要冷蔵保管です。保管温度が高いと失活して効果が減弱していきます。
国内医薬品の場合、海外工場で製造されてから国内の工場へ、製薬会社の厳格な品質管理のもと輸送されます。その後、国内流通網を使ってクリニックに納品されます。
海外医薬品の場合、海外の医薬品卸業者が日本の輸入代行業者を通してクリニックへ配送します。卸業者の保管方法や、日本への輸送方法が悪い場合には、品質が劣化するリスクが生じます。製品によって効果にムラがあると言うドクターもいますので、そこには品質管理の問題があるのかもしれません。
通常の流通経路のパターンは以下のようになります。
国内医薬品の流通経路
製薬会社の管理の元、国内製薬会社へ
製薬会社が保管。国内流通網でクリニックへ
病院・クリニック内で保管し、治療へ
海外医薬品の流通経路
製薬会社の管理の元、海外の卸業者へ
卸業者が保管。輸入代行会社が国内のクリニックへ
病院・クリニック内で保管し、治療へ
当院では、韓国メディトックス社製のコアトックスというボツリヌストキシン製剤を主に使用しています。コアトックスは日本の販売代理店を通して発注すると、海外卸業者を挟まず、製薬会社から直接クリニックへ納入する流通経路をもっています。
温度記録計付きのコールドチェーン(冷蔵便)で配送されるため、品質は国内医薬品と同等です。実際の臨床でも、ボトックスビスタとコアトックスで効果の差を感じたことはありませんから、流通経路で品質を保てていれば、国内医薬品と海外医薬品に品質の差は生じません。
もちろん、品質管理は、流通経路だけにとどまらず、クリニック内での品質管理・保管状況が大切なことは言うまでもないでしょう。
ちなみに、ボコーチュアはインコボツリヌムトキシンA(IncobotulinumtoxinA)が使われており、常温でも活性が落ちないという特徴があります。25℃以下で保存できるため、流通経路や院内での品質管理が楽になる利点があります。
複合タンパク
ボトックス注射を大量に長期に行っていると、ボツリヌス毒素に対する中和抗体ができ、最初は効いていた注射が効かなくなることがあります。この中和抗体は、製剤に含まれている「複合タンパク質」が原因であるとされています19 21。
ボコーチュア(ゼオミン)は、複合タンパク質が含まれておらず、抗原性が低いため中和抗体の産生が起こりません。そのため、長期間注射しても効果の減弱が起こりにくいと主張されています20 21。コアトックスも製造工程で複合タンパクが除去されています。
- ボコーチュア(旧ゼオミン)
- ゼオマイン
- コアトックス
中和抗体は、高用量で繰り返し治療をした際に産生されると考えられていますが、眉間のシワの注射だけでも中和抗体ができ、その後の治療に反応しなくなってしまった症例も報告されています23。
しかし、多くの美容皮膚科・美容外科医は、通常の美容領域で使用する用量では、抗体産生の有無は無視できると考えています。
中和抗体については、非常に稀であるという報告から高頻度で認められたという報告までありますが、中和抗体自体、あまり効果に影響を及ぼさないのではないかという見解もあります18。
ボトックスの治療効果が出ない場合に、よく中和抗体のせいにされてしまうのですが、中和抗体の測定は研究室レベルしかできず、一般のクリニックや病院ではできないため、原因が中和抗体なのかは未知です。
治療効果がない場合には、中和抗体よりも、まず手技、単位数(量)、調剤、品質管理などの別の要因を疑う必要があります。
人血清アルブミンと動物由来原料
ボツリヌストキシン製剤のほとんどに、添加物として人血清アルブミン(ヒト由来のタンパク質)と牛、羊、豚などの動物由来原料が含まれています。
これは、ボトックスビスタやボコーチュア(ゼオミン)も同様です。
製造工程でウシ(心臓、血液、乳、骨格筋、膵臓)、ヒツジ(血液)及びブタ(血液、膵臓、胃、皮膚)由来成分を使用している。
ボトックスビスタ注用50単位4
添加物 人血清アルブミン 0.25mg
海外製の未承認医薬品では、人血清アルブミンや動物由来の成分が含まれているため、未知の感染症の罹患リスクが理論上ゼロではないという理由で、医師が製剤を輸入する際に患者の同意書の提出が必要です(国内製品と後述するコアトックス、イノトックスは不要)。
人血清アルブミンは主に成分の安定化のために使用されており、動物由来原料は培地成分に使用されています。
国内製品は、国から承認を得た製造方法で作られています。海外医薬品は、それぞれの国で承認を得た方法で製造されています。一つ一つの海外製品に対して、国内で製造方法を承認することができないため、海外製品の使用には同意書が必要なものの、リスクが大きく変わることは考えにくいです。
ちなみに、人血清アルブミンは、1950年代に液状加熱が導入されて以降、今日までウイルスやプリオン病に感染した例は一例も報告されていません。
それでも心配な方は、人血清アルブミンも動物由来原料も含まれていない「コアトックス」と「イノトックス」をお勧めします。人血清アルブミンを安定化剤として配合する代わりに、ポリソルベート20が配合されています。
- コアトックス
- イノトックス


人血清アルブミンや動物由来原料が含有されていても、それらの物質にアレルギーなどがなければ、心配しなくて良いと思います。
代わりに使用されているポリソルベートについても、インフルエンザ、ロタウィルス、ポリオなど多くのワクチンに使用されており、極微量であるため、アレルギーがない方については心配いりません(インフルエンザワクチンで腕が腫れた程度は問題ありません)。
ボツリヌス毒素の種類
全てA型のボツリヌス毒素ですが、国内で使用されているボツリヌストキシンの種類は3つです。
ボトックスには、「オナボツリヌムトキシンA(OnabotulinumtoxinA)」、ディスポートには、「アボボツリヌムトキシンA(AbobotulinumtoxinA)」、前述したように、ボコーチュア(旧ゼオミン)には、「インコボツリヌムトキシンA(IncobotulinumtoxinA)」が使用されています。
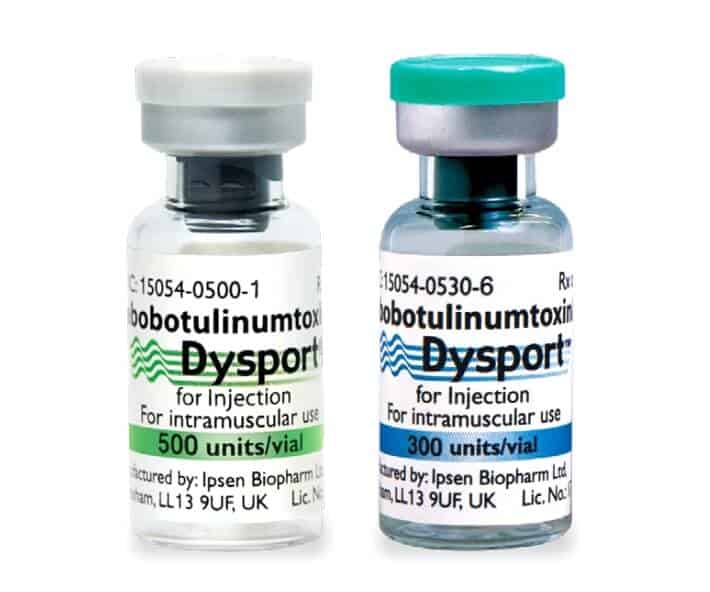
| A型ボツリヌス毒素 | 製品 |
|---|---|
| オナボツリヌムトキシンA OnabotulinumtoxinA | ボトックスビスタ、ボトックス、コアトックス、イノトックス、ニューロノックス、ボツラックス、リジェノックス、ヒュートックス |
| アボボツリヌムトキシンA AbobotulinumtoxinA | ディスポート |
| インコボツリヌムトキシンA IncobotulinumtoxinA | ボコーチュア(ゼオミン)、ゼオマイン |
| ダキシボツリヌムトキシンA DaxibotulinumtoxinA | ダキシファイ |
上の3つは、研究者が有効性や持続性の違いを議論していますが、注入量や濃度が異なるため、正確は比較は困難です11 26 27 28。臨床的には、適切な注射を行えば有効性はさほど変わらないため、あまり気にしなくて構いません。
4つ目の「ダキシボツリヌムトキシン(DaxibotulinumtoxinA)」は、2022年9月にFDAに承認されたボツリヌストキシンです。米レバンス社が開発した新しい製剤で、製品名はダキシファイ(DAXXIFY™)です。
通常、ボトックスの効果は3ヶ月ほどで切れてしまいますが、ダキシファイは眉間のシワに対し、平均6ヶ月間効果が持続し、一部の患者では9ヶ月間も持続しました31 32。
アメリカで承認を受けたばかりですので、日本に輸入されるのは先になると思いますが、前述したヒト血清アルブミンと動物由来原料を含んでおらず33、ボトックスの約2倍も効果が持続するとなると、人気のシワ取り注射になることは間違いなさそうです。
ボトックスと他の製剤の効果の違い
「ボトックスビスタは承認薬だから効果が高い」と思っている方もいるかもしれません。しかし、バイオシミラー製剤だけでなく、全ての製剤も先発医薬品のボトックスと非劣勢試験が行われており、効果はほぼ変わりません。
「韓国製ボトックスは拡散しやすいから細かい場所に向かない」
そんな情報も目にします。
コアトックスやボコーチュアは複合タンパクが除去されている分、分子量が小さくなりますが、拡散にはほとんど影響を与えません。ボツリヌストキシン製剤の粘度は水のようにサラサラですから、組織内の拡散のしやすさはどの製剤も大差なく、製剤の違いよりも調整濃度の違いに依存します。
つまり、薄い濃度で作れば拡散しやすくなりますし、濃く作れば拡散しにくくなります。ボツリヌストキシン製剤の効果の良し悪しは、製剤自体の問題よりも以下の問題に起因しています。
- 注射技術(適切な部位と深さに注射しているか)
- 単位数(適切な量を注射しているか)
- 濃度(適正に調剤されているか)
- 品質管理(流通・保管過程で活性が保たれているか)
- 中和抗体(ボツリヌス毒素に対する抗体があるか)
おすすめのボツリヌストキシン製剤
現時点で、当院では「コアトックス」をおすすめしています。他の製剤よりやや高価ですが、推奨する理由として、複合タンパク除去、ヒト血清アルブミン不使用、動物由来原料不使用という点が挙げられます。
ただ、前述したようにヒト血清アルブミンや動物由来原料のリスクはほぼゼロに近く、複合タンパクの有無も、半年ごとに数カ所のシワを治療する程度であれば、あまり気にしなくて良いかもしれません。
肩こり、脚痩せ、多汗症、複数箇所のシワなど、高用量を繰り返し使う場合には、複合タンパクが除去され、抗体産生が起こりにくいとされる「コアトックス」や「ボコーチュア」を推奨します。ボツリヌストキシン治療は、何十年と継続、反復するため、抗体産生をできるだけ防ぐという観点から治療24 25をするほうが良いと考えているからです。
流通経路におけるボトックスビスタやボトックスの品質が安定していることは間違いありません。眉間と目尻のシワ(承認薬の範囲内)で治療を受けたい方は、ボトックスビスタが良いでしょう。
イノトックスは液体型(溶解済み)で、調剤時の濃度ミスが発生しない利点があります。
ニューロノックス、ボツラックス、リジェノックス、ヒュートックスはボトックスのバイオシミラー品として各国の承認制度の元、同等性の試験がなされていますから、流通時の品質管理の問題が生じなければ、安価で良い製剤です。
ボツリヌストキシン製剤には、価格なども含めてそれぞれの利点がありますので、ご自分にあったものを選択してください。

参考文献・サイト一覧
- GSK「ボトックス A型ボツリヌス毒素製剤 開発の経緯」https://gskpro.com/ja-jp/products-info/botox/all/history/ 最終アクセス2022/07/28
- PMDA 独立行政法人 医薬品医薬品機器総合機構 「医薬品副作用救済制度」https://www.pmda.go.jp/kenkouhigai_camp/ 最終アクセス2022/08/04
- 小崎 俊司, 鎌田 洋一 「ボツリヌス神経毒素の構造と作用発現機構」日本細菌学雑誌 51 (2): 513-522, 1996 日本細菌学会
- PMDA 独立行政法人医薬品医療機器総合機構「ボトックスビスタ 添付文書」https://www.info.pmda.go.jp/go/pack/122940AD1026_2_11/?view=frame&style=XML&lang=ja 最終アクセス2022/08/04
- PMDA 独立行政法人医薬品医療機器総合機構「ボトックス注用50単位/ボトックス注用100単位 添付文書」https://www.info.pmda.go.jp/go/pack/1229404D1020_1_12/ 最終アクセス2022/08/04
- 帝人ファーマ株式会社「A型ボツリヌス毒素製剤の製造販売承認を取得」2020年6月29日 https://www.teijin.co.jp/news/2020/06/29/20200629_02.pdf
- エーザイ株式会社 「B型ボツリヌス毒素製剤「ナーブロック®筋注2500単位」 日本で製造販売承認を取得」2011年1月21日 https://www.eisai.co.jp/news/news201105.html
- KEGG データベース「ナーブロック 添付文書情報」https://www.kegg.jp/medicus-bin/japic_med?japic_code=00061314 最終アクセス2022/08/04
- Supernus 「MYOBLOC Prescribing Information」https://www.myobloc.com/files/MYOBLOC_PI.pdf 最終アクセス2022/08/04
- IPSEN「Ipsen Announces FDA Approval of Dysport® (abobotulinumtoxinA) for the Treatment of Upper Limb Spasticity in Children, Excluding Cerebral Palsy」SEPTEMBER 26, 2019 https://www.ipsen.com/us/blog/press-releases/ipsen-announces-fda-approval-of-dysport-abobotulinumtoxina-for-the-treatment-of-upper-limb-spasticity-in-children-excluding-cerebral-palsy/
- Field M, Splevins A, Picaut P, van der Schans M, Langenberg J, Noort D, Snyder D, Foster K. AbobotulinumtoxinA (Dysport®), OnabotulinumtoxinA (Botox®), and IncobotulinumtoxinA (Xeomin®) Neurotoxin Content and Potential Implications for Duration of Response in Patients. Toxins (Basel). 2018 Dec 13;10(12):535. doi: 10.3390/toxins10120535. Erratum in: Toxins (Basel). 2019 Feb 13;11(2): PMID: 30551641; PMCID: PMC6316182.
- Merz Pharma 「BOCOUTURE®」https://www.merz.ch/produkte/bocouture/
- 帝人ファーマ株式会社「ゼオマイン筋注用_プロダクトニュース」https://medical.teijin-pharma.co.jp/content/dam/teijin-medical-web/sites/documents/news/2020/20201118/fcn28e000000ilj3.pdf 最終アクセス2022/08/07
- GSK「ボトックス 製品基本情報」https://gskpro.com/ja-jp/products-info/botox/index/
- PMDA 独立行政法人医薬品医療機器総合機構「ボトックスビスタ注用50単位患者向医薬品ガイド」https://www.info.pmda.go.jp/downfiles/guide/ph/111932_122940AD1026_2_00G.pdf
- Medytox「Botulinum Toxin Product」http://www.medytox.com/page/innotox_en?site_id=en
- 食品安全委員会 添加物専門調査会「(案)ポリソルベート類(ポリソルベート20,60,65,80)」https://www.fsc.go.jp/iken-bosyu/pc_tenkabutu_polysor190412.pdf 最終アクセス2022/08/05
- Lange O, Bigalke H, Dengler R, Wegner F, deGroot M, Wohlfarth K. Neutralizing antibodies and secondary therapy failure after treatment with botulinum toxin type A: much ado about nothing? Clin Neuropharmacol. 2009 Jul-Aug;32(4):213-8. doi: 10.1097/WNF.0b013e3181914d0a. PMID: 19620852.
- Dressler D. Five-year experience with incobotulinumtoxinA (Xeomin(®) ): the first botulinum toxin drug free of complexing proteins. Eur J Neurol. 2012 Mar;19(3):385-9. doi: 10.1111/j.1468-1331.2011.03559.x. Epub 2011 Oct 28. PMID: 22035051.
- Frevert J. Pharmaceutical, biological, and clinical properties of botulinum neurotoxin type A products. Drugs R D. 2015 Mar;15(1):1-9. doi: 10.1007/s40268-014-0077-1. PMID: 25559581; PMCID: PMC4359186.
- Frevert J, Dressler D. Complexing proteins in botulinum toxin type A drugs: a help or a hindrance? Biologics. 2010 Dec 9;4:325-32. doi: 10.2147/BTT.S14902. PMID: 21209727; PMCID: PMC3010823.
- Albrecht P, Jansen A, Lee JI, Moll M, Ringelstein M, Rosenthal D, Bigalke H, Aktas O, Hartung HP, Hefter H. High prevalence of neutralizing antibodies after long-term botulinum neurotoxin therapy. Neurology. 2019 Jan 1;92(1):e48-e54. doi: 10.1212/WNL.0000000000006688. Epub 2018 Nov 21. Erratum in: Neurology. 2022 Feb 22;98(8):341. PMID: 30464031.
- Stengel G, Bee EK. Antibody-induced secondary treatment failure in a patient treated with botulinum toxin type A for glabellar frown lines. Clin Interv Aging. 2011;6:281-4. doi: 10.2147/CIA.S18997. Epub 2011 Nov 9. PMID: 22162643; PMCID: PMC3230581.
- Ho WWS, Albrecht P, Calderon PE, Corduff N, Loh D, Martin MU, Park JY, Suseno LS, Tseng FW, Vachiramon V, Wanitphakdeedecha R, Won CH, Yu JNT, Dingley M. Emerging Trends in Botulinum Neurotoxin A Resistance: An International Multidisciplinary Review and Consensus. Plast Reconstr Surg Glob Open. 2022 Jun 20;10(6):e4407. doi: 10.1097/GOX.0000000000004407. PMID: 35747253; PMCID: PMC9208887.
- Park JY, Corduff N, Frevert J, Wanitphakdeedecha R, Chao YYY. Immunogenicity Associated with Aesthetic Botulinumtoxin A: A Survey of Asia-Pacific Physicians’ Experiences and Recommendations. Plast Reconstr Surg Glob Open. 2022 Apr 18;10(4):e4217. doi: 10.1097/GOX.0000000000004217. PMID: 35450268; PMCID: PMC9015201.
- Scaglione F. Conversion Ratio between Botox®, Dysport®, and Xeomin® in Clinical Practice. Toxins (Basel). 2016 Mar 4;8(3):65. doi: 10.3390/toxins8030065. PMID: 26959061; PMCID: PMC4810210.
- Grosset DG, Tyrrell EG, Grosset KA. Switch from abobotulinumtoxinA (Dysport®) to incobotulinumtoxinA (Xeomin®) botulinum toxin formulation: a review of 257 cases. J Rehabil Med. 2015 Feb;47(2):183-6. doi: 10.2340/16501977-1895. PMID: 25325305.
- Kutschenko A, Manig A, Reinert MC, Mönnich A, Liebetanz D. In-vivo comparison of the neurotoxic potencies of incobotulinumtoxinA, onabotulinumtoxinA, and abobotulinumtoxinA. Neurosci Lett. 2016 Aug 3;627:216-21. doi: 10.1016/j.neulet.2016.06.001. Epub 2016 Jun 3. PMID: 27268041.
- IPSEN CARES Dysport® (abobotulinumtoxinA) Resource Guide https://d3er5u4d173tp7.cloudfront.net/websites/ipsencares_com/wp-content/uploads/sites/2/2021/07/21091529/DYS-US-005869-Dysport-Resource-Guide-Update_electronic-FINAL.pdf 最終アクセス2022/08/05
- HUGEL Botulinum Toxin Botulax® 100 unit http://www.hugel.co.kr/en/m21.php 最終アクセス2022/08/05
- Bertucci V, Solish N, Kaufman-Janette J, Yoelin S, Shamban A, Schlessinger J, Snyder D, Gallagher C, Liu Y, Shears G, Rubio RG. DaxibotulinumtoxinA for Injection has a prolonged duration of response in the treatment of glabellar lines: Pooled data from two multicenter, randomized, double-blind, placebo-controlled, phase 3 studies (SAKURA 1 and SAKURA 2). J Am Acad Dermatol. 2020 Apr;82(4):838-845. doi: 10.1016/j.jaad.2019.06.1313. Epub 2019 Nov 29. PMID: 31791824.
- Carruthers JD, Fagien S, Joseph JH, Humphrey SD, Biesman BS, Gallagher CJ, Liu Y, Rubio RG; SAKURA 1 and SAKURA 2 Investigator Group; SAKURA 1 and SAKURA 2 Investigator Group includes the following. DaxibotulinumtoxinA for Injection for the Treatment of Glabellar Lines: Results from Each of Two Multicenter, Randomized, Double-Blind, Placebo-Controlled, Phase 3 Studies (SAKURA 1 and SAKURA 2). Plast Reconstr Surg. 2020 Jan;145(1):45-58. doi: 10.1097/PRS.0000000000006327. PMID: 31609882; PMCID: PMC6940025.
- REVANCE Revance Announces FDA Approval of DAXXIFY™ (DaxibotulinumtoxinA-lanm) for Injection, the First and Only Peptide-Formulated Neuromodulator With Long-Lasting Results September 08, 2022 最終アクセス2022/09/09
関連ページ-Related Pages-
-
ボツリヌストキシン治療
肌のクリニック(高円寺・麹町)では、コアトックス®を使用したボツリヌストキシン治療を提供しています。耐性がつきにくく、自然な仕上がりが特徴です。シワやエラ張り、多汗症、肩こり、人中短縮、小鼻縮小など、さまざまなお悩みに対応しています。 -
シワ取り / ボツリヌストキシン
額・眉間・目尻などの表情ジワに対して、自然な表情を保ちながらシワの改善が期待できます。短時間の施術でダウンタイムもほとんどありません。施術は肌のクリニック(高円寺・麹町)で受けられます。 -
人中短縮・小鼻縮小 / ボツリヌストキシン
上唇や小鼻にボツリヌストキシン注射をすることで、人中を短く見せたり小鼻の広がりを抑えることが可能です。メスを使わず自然な変化を求める方におすすめ。施術は肌のクリニック(高円寺・麹町)で行っています。 -
多汗症 / ボツリヌストキシン
脇や手足の汗を抑えるコアトックス®による多汗症治療で、効果は約3~4ヶ月持続します。発汗が抑えられ、日常生活を快適に過ごすことができます。治療は肌のクリニック(高円寺・麹町)で提供しています。







