肌のクリニックのメディカルダイエット医師管理のもと、安心・効果的に取り組む医療ダイエット
当院では、医師の診察と定期検査を基本とした、安全性に配慮したメディカルダイエット(医療ダイエット)を提供しています。
治療には、GLP-1受容体作動薬をはじめとするエビデンスに基づいた薬剤を使用し、科学的根拠に基づいた個別プランで無理なく減量をサポート。食事・運動指導も組み合わせ、持続的な体質改善を目指します。GLP-1受容体作動薬は、食欲を抑え血糖コントロールを改善することにより、医療ダイエットにおける有力な選択肢として注目されています。
安全なダイエット治療のための検査体制
- 医師による診察と継続的な健康チェック
- 肝機能・腎機能・甲状腺がんマーカーなど、約30項目の血液検査を定期実施
- 血糖値・HbA1cのモニタリングで、低血糖リスクも徹底管理
- 科学的データに基づいた個別最適な治療プラン
- 進行状況に応じた継続的な安全評価と治療調整
当院で扱うダイエット治療薬
| 薬剤 | 効果 | 用法 | 特徴 |
|---|---|---|---|
| マンジャロ | 週1回注射 | GIP / GLP-1受容体に働きかけ、食欲を抑えエネルギー消費を高める | |
| オゼンピック | 週1回注射 | GLP-1受容体に働きかけ、食欲を抑えエネルギー消費を高める | |
| リベルサス | 1日1回内服 | ||
| ルセフィ | 1日1回内服 | 腎臓での糖の再吸収を抑え、尿中に糖を排出 | |
| メトホルミン | 1日2回内服 | 肝臓の糖新生を抑制し、消化管からの糖の吸収を抑える 腸からのGLP-1分泌を促し、食欲を抑える |
マンジャロ
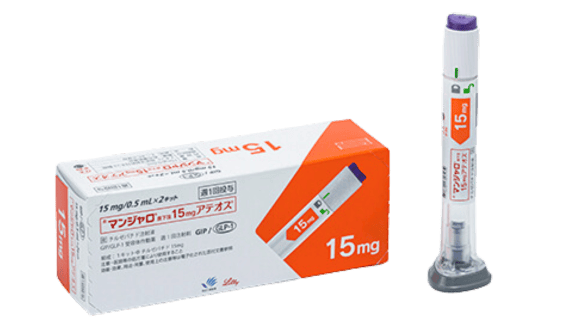
マンジャロ(チルゼパチド)は、週に1回の注射で食欲を抑え、エネルギー消費を高めてる痩せる薬です。特に、食欲抑制に働くGLP-1受容体だけでなく、GIP受容体にも作用するため、より高い減量効果が期待できます。
マンジャロは糖尿病治療薬として承認されていますが、肥満治療薬としては未承認のため、医薬品副作用被害救済制度の対象外です。
マンジャロの料金(税込)
| 薬剤 | 1本の価格 (1週間分) | 4本の価格 (4週間分) |
|---|---|---|
| マンジャロ 2.5mg | 5,500円 | 22,000円 |
| マンジャロ 5mg | 9,900円 | 39,600円 |
| マンジャロ 7.5mg | 14,300円 | 57,200円 |
| マンジャロ 10mg | 18,700円 | 74,800円 |
| マンジャロ 12.5mg | 23,100円 | 92,400円 |
| マンジャロ 15mg | 26,400円 | 105,600円 |
| その他 | 価格 |
|---|---|
| アルコール綿 20枚 | 165円 |
| 吐き気止め 10日分 | 660円 |
- 処方には診察(初診3,850円 / 再診1,650円)が必要です。また、初診時と3ヶ月毎に副作用チェックのための採血(3,982円)が必要となります。
- マンジャロは使用後、針がペン内に自動的に収納されます。フタが閉められる硬い容器(牛乳パックなど)に入れ、ガムテープでフタを閉じ、燃えるゴミとして廃棄できます。当院で廃棄をご希望の場合、医療廃棄物代(440円)がかかります。
各種薬剤(ダイエット目的)の使い方
マンジャロの使い方
保存方法
凍結を避け冷蔵庫(2~8℃)で保管してください。3週間以内であれば、室温(30℃以下)でも保管できます。
注射方法
週に1回、同じ曜日に腹部、太もものいずれかの皮下(脂肪)に注射します。食前食後は関係ありません。筋肉や静脈には注射しないでください。診察時にお渡しする「使用方法」に従って正しくお使いください。
注射間隔と用量
| 期間 | 投与量 |
|---|---|
| 1 – 4週目 | 2.5mg / 週1回 |
| 5 – 8週目 | 5mg / 週1回 |
| 9 – 12週目 | 7.5mg / 週1回 |
| 13 – 16週目 | 10mg / 週1回 |
| 17 – 20週目 | 12.5mg / 週1回 |
| 21週目以降 | 15mg / 週1回 |
最初は吐き気や気分不快などの症状が出るため、慣れさせるために1週間に1回、2.5mgから注射を開始し、表に従って4週間毎に最大15mgまで増やします。
- 効果が著しい場合や副作用が持続する場合は、増量せずに同じ量で経過をみてください。
治療を受けられない可能性のある方
下記の項目に該当する方は、ダイエット治療を受けられない可能性があります。
A.全てのダイエット治療を受けられない可能性がある方
- 妊娠中、授乳中の方
- 糖尿病の方(保険医療機関でご相談ください)
- 重度の腎障害、肝障害のある方
- 腹部手術、または、イレウス(腸閉塞)の既往のある方
- 同種の薬剤でアレルギーを起こしたことがある方
- 低血糖を起こす恐れのある方(激しい運動、過度のアルコール摂取、脳下垂体機能不全、副腎機能不全等)
- 摂食障害の方、痩せすぎの方(BMI18.5未満、体脂肪率が男性15%未満・女性25%未満)
上記Aの項目に加え、下記に該当する方は、治療を受けられない可能性があります。
マンジャロ、オゼンピック、リベルサスの治療を受けられない可能性がある方
- Aの項目に該当する方
- 重度の消化管疾患、膵炎のある方
- うつ、自殺企図のある方
- 甲状腺疾患のある方、甲状腺髄様癌や多発性内分泌腫瘍症2型(MEN2)の家族歴のある方
各薬剤の副作用
マンジャロ、オゼンピック、リベルサスの副作用
- 1. 消化器症状
-
吐き気、嘔吐、下痢、便秘、腹部不快感、腹痛、膨満感などが最も多く見られます。通常は一過性で、治療を続けると軽減します。
- 2. 注射部位の反応(リベルサスを除く)
-
注射部位に赤みや腫れ、しこりなどが現れることがあります。多くは一過性ですが、続く場合は医師に相談してください。注射部位は毎回少しずらし、異なる場所に注射することを推奨します。
- 3. 腎障害
-
下痢や嘔吐による脱水が原因で腎障害が起こることがあります。十分な水分補給を心がけてください。
- 4. 心拍数増加
-
持続的に脈が速くなる場合は、服用を中止し医師に相談してください。
- 5. 低血糖
-
冷や汗、ふるえ、動悸、空腹感、頭痛、眠気、けいれん等の症状が現れた場合、砂糖20gか砂糖を含むジュース200mlを摂取し、安静にしてください。車や機械の操作、高所作業は症状がないことを確認してから行ってください。
- 6. 急性膵炎・胆石症・胆のう炎・胆管炎・黄疸
-
非常に稀ですが、激しい腹痛や背中の痛み、嘔吐、発熱などが急に起こる場合は、すぐに医療機関を受診してください。急激なダイエットは胆石症のリスクを高めます。体重減少は1ヵ月で5%未満にとどめてください。
- 7. アナフィラキシーショック・血管性浮腫
-
非常に稀ですが、全身のかゆみ、蕁麻疹、顔や喉の腫れ、息苦しさ、ふらつきなどが現れた場合、すぐに救急車を呼び、病院で処置を受けてください。
- 8. 甲状腺C細胞腫瘍(甲状腺髄様癌)
-
ラットやマウスで甲状腺C細胞腫瘍が報告されていますが、人との因果関係は不明です。首の腫れやしこりを感じた場合は、必ず医師に相談してください。当院では、定期的な血清カルシトニン検査(腫瘍マーカー検査)を行います。
妊娠中と授乳中、妊活について
各薬剤とも妊娠中・授乳中は使用できません。マンジャロ・オゼンピック・リベルサスは、妊活を開始する2ヶ月前には使用を中止、ルセフィ・メトホルミンは、妊活を開始する1ヵ月前には使用を中止してください。男性の生殖能力への影響は報告されていません。
各薬剤の相互作用
マンジャロ、オゼンピック、リベルサスとの相互作用(注意)
| 経口避妊薬 | 経口避妊薬(ピル)の効果を低下させる可能性があります。 |
|---|---|
| ワルファリン | ワルファリンの作用を増強、または、減弱させる可能性があります。 |
| 他の糖尿病薬 | 低血糖のリスクが増加します。 |
アルコールとの相互作用
どの薬も、少量の飲酒であれば問題ありませんが、多量の飲酒は低血糖を引き起こすため絶対に避けてください。
【飲酒量の目安】一般的には、1日あたりビールなら500mL、日本酒なら1合、ワインなら200mL以下が適量とされています。
ダイエット薬(糖尿病薬)同士の相互作用
GLP-1受容体作動薬(マンジャロ、オゼンピック、リベルサス)、SGLT2阻害薬(ルセフィ)、メトホルミンは、低血糖のリスクが低い薬剤ですが、併用するとリスクが高まります。医師の指導のもとで、定期的に診察と検査を受けてください。また、当院以外でダイエット治療薬、糖尿病薬を処方されている場合は、必ず医師に報告してください。
参考文献・サイト一覧
- Singh G, Krauthamer M, Bjalme-Evans M. Wegovy (semaglutide): a new weight loss drug for chronic weight management. J Investig Med. 2022 Jan;70(1):5-13. doi: 10.1136/jim-2021-001952. Epub 2021 Oct 27. PMID: 34706925; PMCID: PMC8717485.
- Gabery S, Salinas CG, Paulsen SJ, Ahnfelt-Rønne J, Alanentalo T, Baquero AF, Buckley ST, Farkas E, Fekete C, Frederiksen KS, Helms HCC, Jeppesen JF, John LM, Pyke C, Nøhr J, Lu TT, Polex-Wolf J, Prevot V, Raun K, Simonsen L, Sun G, Szilvásy-Szabó A, Willenbrock H, Secher A, Knudsen LB, Hogendorf WFJ. Semaglutide lowers body weight in rodents via distributed neural pathways. JCI Insight. 2020 Mar 26;5(6):e133429. doi: 10.1172/jci.insight.133429. PMID: 32213703; PMCID: PMC7213778.
- US Food and Drug Administration . Wegovy prescribing information. https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.process&ApplNo=215256 最終アクセス2020.12.02.
- Rubino DM, Greenway FL, Khalid U, O’Neil PM, Rosenstock J, Sørrig R, Wadden TA, Wizert A, Garvey WT; STEP 8 Investigators. Effect of Weekly Subcutaneous Semaglutide vs Daily Liraglutide on Body Weight in Adults With Overweight or Obesity Without Diabetes: The STEP 8 Randomized Clinical Trial. JAMA. 2022 Jan 11;327(2):138-150. doi: 10.1001/jama.2021.23619. PMID: 35015037; PMCID: PMC8753508.
- novo nordisk “Wegovy semaglutide injection 2.4mg” https://www.wegovy.com/
- Wadden TA, Bailey TS, Billings LK, Davies M, Frias JP, Koroleva A, Lingvay I, O’Neil PM, Rubino DM, Skovgaard D, Wallenstein SOR, Garvey WT; STEP 3 Investigators. Effect of Subcutaneous Semaglutide vs Placebo as an Adjunct to Intensive Behavioral Therapy on Body Weight in Adults With Overweight or Obesity: The STEP 3 Randomized Clinical Trial. JAMA. 2021 Apr 13;325(14):1403-1413. doi: 10.1001/jama.2021.1831. PMID: 33625476; PMCID: PMC7905697.
- Kushner RF, Calanna S, Davies M, Dicker D, Garvey WT, Goldman B, Lingvay I, Thomsen M, Wadden TA, Wharton S, Wilding JPH, Rubino D. Semaglutide 2.4 mg for the Treatment of Obesity: Key Elements of the STEP Trials 1 to 5. Obesity (Silver Spring). 2020 Jun;28(6):1050-1061. doi: 10.1002/oby.22794. PMID: 32441473; PMCID: PMC7318657.
- Buse JB, Bode BW, Mertens A, Cho YM, Christiansen E, Hertz CL, Nielsen MA, Pieber TR; PIONEER 7 investigators. Long-term efficacy and safety of oral semaglutide and the effect of switching from sitagliptin to oral semaglutide in patients with type 2 diabetes: a 52-week, randomized, open-label extension of the PIONEER 7 trial. BMJ Open Diabetes Res Care. 2020 Dec;8(2):e001649. doi: 10.1136/bmjdrc-2020-001649. PMID: 33318068; PMCID: PMC7737050.
- Rubino D, Abrahamsson N, Davies M, Hesse D, Greenway FL, Jensen C, Lingvay I, Mosenzon O, Rosenstock J, Rubio MA, Rudofsky G, Tadayon S, Wadden TA, Dicker D; STEP 4 Investigators. Effect of Continued Weekly Subcutaneous Semaglutide vs Placebo on Weight Loss Maintenance in Adults With Overweight or Obesity: The STEP 4 Randomized Clinical Trial. JAMA. 2021 Apr 13;325(14):1414-1425. doi: 10.1001/jama.2021.3224. PMID: 33755728; PMCID: PMC7988425.
- Ghusn W, De la Rosa A, Sacoto D, Cifuentes L, Campos A, Feris F, Hurtado MD, Acosta A. Weight Loss Outcomes Associated With Semaglutide Treatment for Patients With Overweight or Obesity. JAMA Netw Open. 2022 Sep 1;5(9):e2231982. doi: 10.1001/jamanetworkopen.2022.31982. PMID: 36121652; PMCID: PMC9486455.
- Lingvay I, Hansen T, Macura S, Marre M, Nauck MA, de la Rosa R, Woo V, Yildirim E, Wilding J. Superior weight loss with once-weekly semaglutide versus other glucagon-like peptide-1 receptor agonists is independent of gastrointestinal adverse events. BMJ Open Diabetes Res Care. 2020 Oct;8(2):e001706. doi: 10.1136/bmjdrc-2020-001706. PMID: 33115821; PMCID: PMC7594204.
- Wilding JPH, Batterham RL, Davies M, Van Gaal LF, Kandler K, Konakli K, Lingvay I, McGowan BM, Oral TK, Rosenstock J, Wadden TA, Wharton S, Yokote K, Kushner RF; STEP 1 Study Group. Weight regain and cardiometabolic effects after withdrawal of semaglutide: The STEP 1 trial extension. Diabetes Obes Metab. 2022 Aug;24(8):1553-1564. doi: 10.1111/dom.14725. Epub 2022 May 19. PMID: 35441470; PMCID: PMC9542252.
- Smits MM, Van Raalte DH. Safety of Semaglutide. Front Endocrinol (Lausanne). 2021 Jul 7;12:645563. doi: 10.3389/fendo.2021.645563. Erratum in: Front Endocrinol (Lausanne). 2021 Nov 10;12:786732. PMID: 34305810; PMCID: PMC8294388.
- ノボノルディスクファーマ 「ウゴービ® 肥満症治療剤 持続性GLP-1 受容体作動薬」https://pro.novonordisk.co.jp/products/wegovy.html 最終アクセス:2023.05.03
- ノボノルディスクファーマ 「ウゴービ® 添付文書」 chrome-extension://efaidnbmnnnibpcajpcglclefindmkaj/https://pro.novonordisk.co.jp/content/dam/hcpexperience/jp/ja/documents/products/wegovy/Wegovy_PI_latest.pdf.coredownload.inline.pdf 最終アクセス:2023.05.03
- O’Neil PM, Birkenfeld AL, McGowan B, Mosenzon O, Pedersen SD, Wharton S, Carson CG, Jepsen CH, Kabisch M, Wilding JPH. Efficacy and safety of semaglutide compared with liraglutide and placebo for weight loss in patients with obesity: a randomised, double-blind, placebo and active controlled, dose-ranging, phase 2 trial. Lancet. 2018 Aug 25;392(10148):637-649. doi: 10.1016/S0140-6736(18)31773-2. Epub 2018 Aug 16. PMID: 30122305.
- Davies M, Pieber TR, Hartoft-Nielsen ML, Hansen OKH, Jabbour S, Rosenstock J. Effect of Oral Semaglutide Compared With Placebo and Subcutaneous Semaglutide on Glycemic Control in Patients With Type 2 Diabetes: A Randomized Clinical Trial. JAMA. 2017 Oct 17;318(15):1460-1470. doi: 10.1001/jama.2017.14752. PMID: 29049653; PMCID: PMC5817971.
- M.S. Capehorn, A.-M. Catarig, J.K. Furberg, A. Janez, H.C. Price, S. Tadayon, B. Vergès, M. Marre, Efficacy and safety of once-weekly semaglutide 1.0mg vs once-daily liraglutide 1.2mg as add-on to 1–3 oral antidiabetic drugs in subjects with type 2 diabetes (SUSTAIN 10), Diabetes & Metabolism, Volume 46, Issue 2, 2020, Pages 100-109, ISSN 1262-3636, https://doi.org/10.1016/j.diabet.2019.101117. (https://www.sciencedirect.com/science/article/pii/S1262363619301326)
- ノボノルディスクファーマ株式会社 2型糖尿病治療剤 経口GLP-1受容体作動薬 セマグルチド(遺伝子組換え)リベルサス錠3mg リベルサス錠7mg リベルサス錠14mg 2021年9月改定(第2版)
- MSD Connect リベルサス 作用機序 https://www.msdconnect.jp/products/rybelsus/action_mechanism.xhtml 最終アクセス 2021/11/27.
- Ottney A. Glucagon-like peptide-1 receptor agonists for weight loss in adult patients without diabetes. Am J Health Syst Pharm. 2013 Dec 1;70(23):2097-103. doi: 10.2146/ajhp130081. PMID: 24249759.
- Aroda VR, Rosenstock J, Terauchi Y, Altuntas Y, Lalic NM, Morales Villegas EC, Jeppesen OK, Christiansen E, Hertz CL, Haluzík M; PIONEER 1 Investigators. PIONEER 1: Randomized Clinical Trial of the Efficacy and Safety of Oral Semaglutide Monotherapy in Comparison With Placebo in Patients With Type 2 Diabetes. Diabetes Care. 2019 Sep;42(9):1724-1732. doi: 10.2337/dc19-0749.
- Gibbons C, Blundell J, Tetens Hoff S, Dahl K, Bauer R, Baekdal T. Effects of oral semaglutide on energy intake, food preference, appetite, control of eating and body weight in subjects with type 2 diabetes. Diabetes Obes Metab. 2021 Feb;23(2):581-588. doi: 10.1111/dom.14255. Epub 2020 Nov 27. PMID: 33184979; PMCID: PMC7839771.
- Yamada Y, Katagiri H, Hamamoto Y, Deenadayalan S, Navarria A, Nishijima K, Seino Y; PIONEER 9 investigators. Dose-response, efficacy, and safety of oral semaglutide monotherapy in Japanese patients with type 2 diabetes (PIONEER 9): a 52-week, phase 2/3a, randomised, controlled trial. Lancet Diabetes Endocrinol. 2020 May;8(5):377-391. doi: 10.1016/S2213-8587(20)30075-9. PMID: 32333875.
- Yabe D, Nakamura J, Kaneto H, Deenadayalan S, Navarria A, Gislum M, Inagaki N; PIONEER 10 Investigators. Safety and efficacy of oral semaglutide versus dulaglutide in Japanese patients with type 2 diabetes (PIONEER 10): an open-label, randomised, active-controlled, phase 3a trial. Lancet Diabetes Endocrinol. 2020 May;8(5):392-406. doi: 10.1016/S2213-8587(20)30074-7. PMID: 32333876.
- Rosenstock J, Allison D, Birkenfeld AL, Blicher TM, Deenadayalan S, Jacobsen JB, Serusclat P, Violante R, Watada H, Davies M; PIONEER 3 Investigators. Effect of Additional Oral Semaglutide vs Sitagliptin on Glycated Hemoglobin in Adults With Type 2 Diabetes Uncontrolled With Metformin Alone or With Sulfonylurea: The PIONEER 3 Randomized Clinical Trial. JAMA. 2019 Apr 16;321(15):1466-1480. doi: 10.1001/jama.2019.2942. PMID: 30903796; PMCID: PMC6484814.
- Rodbard HW, Rosenstock J, Canani LH, Deerochanawong C, Gumprecht J, Lindberg SØ, Lingvay I, Søndergaard AL, Treppendahl MB, Montanya E; PIONEER 2 Investigators. Oral Semaglutide Versus Empagliflozin in Patients With Type 2 Diabetes Uncontrolled on Metformin: The PIONEER 2 Trial. Diabetes Care. 2019 Dec;42(12):2272-2281. doi: 10.2337/dc19-0883. Epub 2019 Sep 17. PMID: 31530666.
- Husain M, Birkenfeld AL, Donsmark M, Dungan K, Eliaschewitz FG, Franco DR, Jeppesen OK, Lingvay I, Mosenzon O, Pedersen SD, Tack CJ, Thomsen M, Vilsbøll T, Warren ML, Bain SC; PIONEER 6 Investigators. Oral Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med. 2019 Aug 29;381(9):841-851. doi: 10.1056/NEJMoa1901118. Epub 2019 Jun 11. PMID: 31185157.
- 臨床応用可能な老化細胞除去薬の同定に成功―アルツハイマー病などの加齢関連疾患への治療応用の可能性 順天堂大学 日本医療研究開発機構 最終アクセス: 2024/10/15
- Katsuumi G, Shimizu I, Suda M, Yoshida Y, Furihata T, Joki Y, Hsiao CL, Jiaqi L, Fujiki S, Abe M, Sugimoto M, Soga T, Minamino T. SGLT2 inhibition eliminates senescent cells and alleviates pathological aging. Nat Aging. 2024 Jul;4(7):926-938. doi: 10.1038/s43587-024-00642-y. Epub 2024 May 30. PMID: 38816549; PMCID: PMC11257941.
- Martin-Montalvo A, Mercken EM, Mitchell SJ, Palacios HH, Mote PL, Scheibye-Knudsen M, Gomes AP, Ward TM, Minor RK, Blouin MJ, Schwab M, Pollak M, Zhang Y, Yu Y, Becker KG, Bohr VA, Ingram DK, Sinclair DA, Wolf NS, Spindler SR, Bernier M, de Cabo R. Metformin improves healthspan and lifespan in mice. Nat Commun. 2013;4:2192. doi: 10.1038/ncomms3192. PMID: 23900241; PMCID: PMC3736576.
- Petrocelli JJ, McKenzie AI, de Hart NMMP, Reidy PT, Mahmassani ZS, Keeble AR, Kaput KL, Wahl MP, Rondina MT, Marcus RL, Welt CK, Holland WL, Funai K, Fry CS, Drummond MJ. Disuse-induced muscle fibrosis, cellular senescence, and senescence-associated secretory phenotype in older adults are alleviated during re-ambulation with metformin pre-treatment. Aging Cell. 2023 Nov;22(11):e13936. doi: 10.1111/acel.13936. Epub 2023 Jul 24. PMID: 37486024; PMCID: PMC10652302.
- Soukas AA, Hao H, Wu L. Metformin as Anti-Aging Therapy: Is It for Everyone? Trends Endocrinol Metab. 2019 Oct;30(10):745-755. doi: 10.1016/j.tem.2019.07.015. Epub 2019 Aug 9. PMID: 31405774; PMCID: PMC6779524.
- The TAME Trial Targeting the Biology of Aging. Ushering a New Era of Interventions. The official web resource of the TAME Trial, managed by the American Federation for Aging Research.